Akutt myelogen leukemi (AML)
Akutt myelogen leukemi er en kreftform hvor umodne blodceller, såkalte myeloblaster, vokser og deler seg uhemmet i beinmargen.
Sist oppdatert:
12. juni 2020
Innhold i artikkelen
Hva er akutt myelogen leukemi?
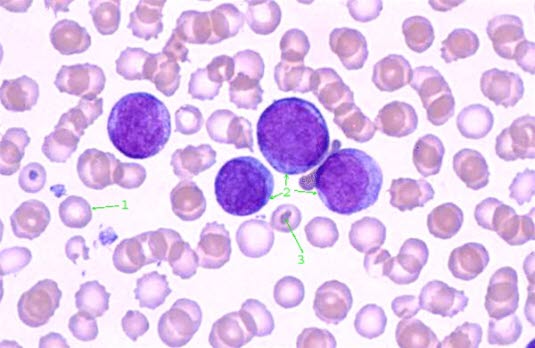 Illustrasjon: Umodne blodceller typisk ved blodkreft
Illustrasjon: Umodne blodceller typisk ved blodkreftAML er en form for blodkreft hvor umodne blodceller i beinmargen, såkalte myeloblaster, vokser og deler seg uhemmet. I beinmargen produseres røde og hvite blodlegemer, og blodplater. Den ukontrollerte veksten av kreftcellene fortrenger de normale cellene, og forstyrrer produksjonen av disse. Som følge av overproduksjon av kreftsyke hvite blodceller, blir det for lite røde blodlegemer og blodplater, og mangel på normale hvite blodceller.
Animasjon om akutt myelogen leukemi
Forekomst
Antall nye tilfeller per år er rundt 3 per 100 000 innbyggere i Norge. I perioden 2011 til 2015 var det i gjennomsnitt 129 personer som fikk AML hvert år. Av disse var kun noen få barn. Gjennomsnittlig alder ved sykdomsutbrudd var 70 år, men sykdommen finnes i alle aldersgrupper.
Årsak
Hos de aller fleste som får denne sykdommen, kan man ikke finne noen spesiell årsak, årsaken er med andre ord ukjent. Det er funnet at radioaktiv stråling, som for eksempel i forbindelse med kjernekraftulykker, kan føre til denne typen blodkreft. Det er også vist noe økt antall tilfeller hos personer som utsettes for benzen på arbeidsplassen, så som oljeindustriarbeidere, og personer som har blitt behandlet med stråleterapi og noen former for cellegift. Sammenhengen med disse risikofaktorene er imidlertid ikke sterk.
Typisk for kreftcellene i beinmargen ved AML er at de vokser uhemmet og uten å gjennomgå de vanlige modningsstadiene. De har også mistet evnen til å reagere på kroppens regulerende mekanismer. Ofte kan man finne genfeil i disse cellene. Slike genfeil oppstår sannsynligvis spontant i løpet av livet. Sykdommen er ikke arvelig.
Vanlige symptomer og tegn
Oftest utvikler symptomene seg gradvis i løpet av dager til få uker, men de kan også komme over litt lengre tid. Typisk er stadig tilbakevendende luftveisinfeksjoner på grunn av mangel på normale hvite blodlegemer. Blodprosenten går ned, noe som fører til slitenhet, slapphet og blekhet. Mangel på blodplater kan føre til unormale blødninger, plutselige blåflekker i huden eller blødninger fra slimhinner. Noen får smerter i skjelettet, andre kan få hudforandringer.
Diagnostikk
Diagnosen mistenkes ut fra symptomene: slapphet, gjentatte infeksjoner, blødninger. Hos de med lav blodprosent (anemi) og lavt antall blodplater sammen med altfor høyt antall hvite blodlegemer er diagnosen sannsynlig. Der man kan se de typiske umodne kreftcellene ved mikroskopisk undersøkelse av blodet, er diagnosen nesten sikker. Slike funn fører alltid til innleggelse i sykehus for grundigere utredning.
I sykehuset tas prøve fra beinmargen, og diagnosen er sikker dersom det i prøven er mer enn 20 prosent umodne beinmargsceller. I tillegg til å stille diagnosen gjøres det på sykehuset også avanserte undersøkelser som genanalyse av kreftcellene. Genanalysen sier noe om prognosen til sykdommen og bidrar til å bestemme behandling i det enkelte tilfellet.
Behandling
Målet med behandlingen er helbredelse, eventuelt å drive sykdommen tilbake og holde den i sjakk en periode dersom helbredelse ikke er mulig. Behandlingen er kjemoterapi (cellegift), først induksjonsbehandling, deretter såkalt konsolideringsbehandling.
Induksjonsbehandlingen består av en kombinasjon av to sterke cellegifter. Kuren er svært kraftig og slår ut både kreftceller og store deler av de friske cellene i beinmargen. Det er nødvendig med isolasjon, og ofte langvarig antibiotikabehandling og blodoverføringer etter kuren. En del pasienter tåler ikke denne behandlingen. Faren for å dø av behandlingen øker med økende alder og med økende antall andre sykdommer som svekker allmenntilstanden. Hos mange eldre kan man derfor ikke gi denne intense behandlingen, men satse på mildere behandling der formålet er å forlenge livet uten å helbrede.
Dersom behandlingen fjerner alle kreftcellene, har man oppnådd det første målet - som kalles komplett remisjon. Etter at kroppen har kommet til hektene, er neste steg vedlikeholdsbehandling (konsolidering). Den består som regel av gjentatte cellegiftkurer med fire ukers mellomrom. Etter fullført behandling må man fortsette med regelmessige kontroller i mange år. Mange blir helbredet med denne behandlingen, men en ikke ubetydelig andel får tilbakefall.
Transplantasjon av stamceller fra en frisk giver (allogen stamcelletransplantasjon) er et alternativ. I første rekke gjøres dette hos pasienter hvor utsiktene til å bli frisk av vanlig cellegiftbehandling ikke er så gode. Det er også aktuelt hos de som får tilbakefall etter første behandlingsrunde. Transplantasjon krever høydose cellegiftbehandling for å fullstendig utrydde alle kreftcellene før transplantasjonen. Behandlingen har i seg selv høyere dødelighet enn vanlig cellegiftbehandling, og den kan ikke gjennomføres ved høy alder eller svekket helse på grunn av andre sykdommer.
Prognose
Uten behandling er overlevelsen ved AML meget kortvarig. Med behandling vil 70 til 80 prosent av de som er under 60 år, oppnå remisjon. Hos pasienter over 60 år oppnår rundt halvparten remisjon. Noen får tilbakefall og må ha nye kurer. Hvor mange som overlever i fem år eller mer, avhenger av hvilken risikogruppe man er i: for gruppen med lavest risiko er overlevelse over 90 prosent, i gruppen med høyest utgangsrisiko er fem års overlevelse rundt 30 prosent.
Følgetilstander som kan oppstå, er livstruende infeksjoner eller blødninger. Psykiske ettervirkninger kan være angst, depresjon, sorg, og sinne. Under behandlingen oppstår fysiske endringer som vektforandring, oppblåst ansikt og håravfall. Dette kan gi redusert selvfølelse og sosial isolasjon. Hos de fleste er dette forbigående problemer.
Etter behandlingen er det en del som plages med fatigue. Fatigue betyr følelse av utmattelse og energisvikt som ikke bedres ved søvn eller hvile. For mange kan dette i en lang periode være den verste plagen etter gjennomført behandling. Det er viktig å være klar over at dette er en vanlig reaksjon etter cellegiftbehandling (og etter strålebehandling), og at plagene ofte bedres over tid. Det viktigste en kan gjøre er å holde kroppen i gang med forsiktig, ikke utmattende trening. Det kan være fornuftig å samarbeide med en fysioterapeut for å finne det beste aktivitetsnivået.
Dette dokumentet er basert på det profesjonelle dokumentet Akutt myelogen leukemi . Referanselisten for dette dokumentet vises nedenfor
- Helsedirektoratet. Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av maligne blodsykdommer 2019. IS-2806 helsedirektoratet.no
- Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127: 2391-405. pmid:27069254 PubMed
- Tangen J-M, Fløisand Y, Foss-Abrahamsen J, Haukås E, Næss IA, Skjelbakken T. Overlevelse hos voksne med akutt myelogen leukemi. Tidsskr Nor Legeforen 2008; 128: 1164-7. PMID: 18480864 PubMed
- Engholm G, Ferlay J, Christensen N et al. NORDCAN: Cancer Incidence, Mortality, Prevalence and Survival in the Nordic Countries, Version 8.1 (28.06.2018). Association of the Nordic Cancer Registries. Danish Cancer Society. Accessed on 25.02.2019. www.ancr.nu
- Kreftregisteret. Cancer in Norway 2018. Oslo: Kreftregisteret, 2019, www.kreftregisteret.no. www.kreftregisteret.no
- Short NJ, Rytting ME, Cortes JE. Acute myeloid leukaemia. Lancet 2018; 392: 593-606. pmid:30078459 PubMed
- Estey E, Döhner H. Acute myeloid leukaemia. Lancet 2006; 368: 1894-907. PMID: 17126723 PubMed
- Schubauer-Berigan MK, Daniels RD, Bertke SJ et al. Cancer Mortality through 2005 among a Pooled Cohort of U.S. Nuclear Workers Exposed to External Ionizing Radiation. Radiat Res 2015; 183: 620-31. pmid:26010709 PubMed
- Poynter JN, Richardson M, Roesler M et al. Chemical exposures and risk of acute myeloid leukemia and myelodysplastic syndromes in a population-based study. Int J Cancer 2017; 140: 23-33. pmid:27603749 PubMed
- Kelly LM, Gilliland DG. Genetics of myeloid leukemias. Annu Rev Genomics Hum Genet 2002; 3: 179-98. PMID: 12194988 PubMed
- Fröhling S, Scholl C, Gilliland DG, Levine RL. Genetics of myeloid malignancies - pathogenetic and clinical implications. J Clin Oncol 2005; 23: 6285-95. PMID: 16155011 PubMed
- Papaemmanuil E1, Gerstung M1, Bullinger L et al. Genomic Classification and Prognosis in Acute Myeloid Leukemia. N Engl J Med 2016; 374: 2209-21. pmid:27276561 PubMed
- Helsedirektoratet. Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av maligne blodsykdommer 2016. IS-2542
- Fenaux P et al. A randomized comparison of all trans retinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. The European APL-group. Blood 1999; 94: 1192-2000. PMID: 10438706 PubMed
- Döhner H, Weisdorf DJ, Bloomfield CD. Acute Myeloid Leukemia. N Engl J Med 2015; 373: 1136-52. pmid:26376137 PubMed
- Stone RM, Mandrekar SJ, Sanford BL et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med 2017; 377: 454-64. pmid:28644114 PubMed
- Wander SA, Levis MJ, Fathi AT. The evolving role of FLT3 inhibitors in acute myeloid leukemia: quizartinib and beyond. Ther Adv Hematol 2014; 3: 65-77. pmid:24883179 PubMed
- Gasiorowski RE1, Clark GJ, Bradstock K, Hart DN. Antibody therapy for acute myeloid leukaemia. Br J Haematol 2014; 164: 481-95. pmid:24321020 PubMed
- Appelbaum FR, Bernstein ID. Gemtuzumab ozogamicin for acute myeloid leukemia. Blood 2017; 130: 2373-76. pmid:29021230 PubMed
- Helsedirektoratet. Seneffekter etter kreftbehandling. Faglige råd. Oslo: Helsedirektoratet; 2017. IS-2551