Akutt lymfoblastisk leukemi (ALL)
Akutt lymfoblastisk leukemi er blodkreft hvor en bestemt type hvite blodlegemer, lymfocyttene, formerer seg uhemmet. Som en følge av dette vil antallet røde blodlegemer, normale hvite blodlegemer og blodplater reduseres.

Sist oppdatert:
12. juni 2020
Innhold i artikkelen
Hva er akutt lymfoblastisk leukemi (ALL)?
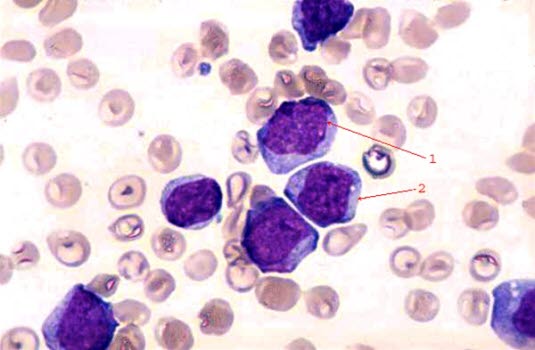 Illustrasjon: Umodne blodceller typisk for blodkreft
Illustrasjon: Umodne blodceller typisk for blodkreftALL er en form for blodkreft hvor en bestemt type hvite blodlegemer, såkalte lymfocytter, formerer seg uhemmet og derfor kommer over i blodet i umoden form, som såkalte lymfoblaster. Kroppen mister kontrollen over disse umodne lymfoblastene. De øker i antall og fortrenger andre celler i beinmarg og blod. Dermed reduseres antallet av de normale celletypene:
- røde blodlegemer
- normale hvite blodlegemer (granulocytter)
- blodplater
Få røde blodlegemer gjør at du blir blodfattig, du får anemi. Færre normale hvite blodlegemer gjør at du får redusert motstandskraft mot infeksjoner. Færre blodplater gjør at du blør uvanlig lett.
Det finnes undergrupper av ALL. Disse klassifiseres på bakgrunn av ulike endringer i kreftcellenes genstruktur.
Animasjon om akutt lymfatisk leukemi
Forekomst
Akutt lymfoblastisk leukemi ble i perioden 2007 til 2016 hos barn under 15 år, påvist i gjennomsnitt hos knapt fem barn per 100 000 per år. Knapt ett barn per 100 000 fikk akutt myelogen leukemi per år i samme periode. Totalt i 2016 fikk 30 barn under 15 år diagnosen ALL. Akutt lymfoblastisk leukemi utgjør rundt 85 prosent av alle blodkrefttilfeller hos barn. Hos voksne er tilstanden betydelig mindre hyppig og utgjør rundt 20 prosent av alle leukemier. I 2018 var det i Norge vel 30 nye tilfeller både blant voksne og barn.
Årsaker
Kreftcellene mister evnen til å modnes. Den ukontrollerte veksten medfører at normale celler fortrenges slik at det utvikles mangel på noen eller alle celletyper i blodet. I de aller fleste tilfellene er det ingen påvisbar årsak til sykdommen. Det er sett at tidligere strålebehandling og behandling med enkelte typer cellegift kan øke risiko. Men dette er årsak kun i et lite antall tilfeller.
Symptomer
Symptomene utvikles som oftest over en relativt kort periode. Vanlige symptomer er
- slapphet og tretthet som følge av den lave blodprosenten
- hyppige infeksjoner fordi antallet normale hvite blodlegemer går ned
- blødninger i hud og slimhinner på grunn av mangel på blodplater
- muskelskjelettsmerter
Andre symptomer kan være uskarpt syn eller dobbeltsyn, utslett, hodepine, kvalme og oppkast (som uttrykk for irritasjon av hjernehinnene).
Diagnostikk
Blødninger i hud eller slimhinner, blodmangel og hyppige infeksjoner kan gi mistanke om sykdommen. Legeundersøkelsen kan styrke mistanken ved at det påvises:
- Blek hud (anemi)
- Hudblødninger
- Pågående infeksjon
- Lymfeknutehevelser
- Stor lever og milt
- Ømhet ved trykk over bein
Blodprøver kan bekrefte diagnosen. Den viktigste prøven utenfor sykehus er mikroskopi av et blodutstryk. Et blodutstryk lages ved å dryppe en dråpe blod på en glassplate. Blodutstryket vil kunne vise en dominans av de umodne lymfoblastene. Ved mistanke om ALL legges personen umiddelbart inn i sykehus. Der bekreftes diagnosen ved undersøkelse av beinmarg. Det tas også en rekke andre spesialtester av blod, beinmarg og eventuelt ryggmargsvæske, hvor det samlede resultatet er viktig for å kunne skreddersy den beste behandlingen.
Behandling
Målet med behandlingen er å helbrede sykdommen og forebygge tilbakefall. Leukemi hos barn er en kreftsykdom med gode utsikter. Behandlingen er intens og langvarig for å prøve å helbrede så mange som mulig. Optimal behandling kreve at man klassifiserer leukemien nøyaktig. De fleste barn med kreft i Norge og i andre land behandles etter internasjonale behandlingsoppsett.
Behandlingen består av flere typer cellegift som gis i to trinn eller faser: Oppstartsbehandlingen (eller induksjonsfasen) består av sterke cellegifter som fullstendig slår ut de ondartede cellene, og mer eller mindre også de normale cellene i beinmargen.
Etter at den syke og beinmargen er kommet til hektene, fortsettes det med vedlikeholdsbehandling (eller konsolideringsfase) hvor det gis en blanding av cellegifter i kurer med noen ukers pause mellom hver kur. Målsetningen er da at alle kreftcellene skal være fjernet, mens de normale cellene har overlevd. Dersom en oppnår det, kalles det remisjon - sykdommen er slått tilbake. Et flertall av pasientene som gjennomgår behandling, oppnår remisjon. Spesielt hos barn oppnår nesten alle remisjon (rundt 98 prosent), tallet er noe lavere hos voksne.
Unge voksne utgjør en særlig undergruppe som synes å ha en markant bedre prognose ved behandling etter opplegget for barn, mens eldre voksne ofte ikke tåler denne intensive behandlingen.
Etter induksjonsfasen er immunapparatet helt utslått. I denne perioden kreves innleggelse og isolasjon for å unngå smitte. Alle behandles med antibiotika og blodoverføringer etter behov. Også under konsolideringskurene er man utsatt for infeksjoner og blodmangel, og alle blir kontrollert regelmessig og hyppig for å kunne behandle eventuelle komplikasjoner så raskt som mulig.
Noen er ikke varig helbredet og får tilbakefall etter behandlingen. I slike situasjoner kan nye cellegiftbehandlinger være aktuelt, eventuelt forsøkes såkalt allogen stamcelletransplantasjon. Det vil si at den syke får overført stamceller (morceller) fra en frisk giver, enten et familiemedlem eller en fremmed giver som har tilstrekkelig god vevslikhet.
Stamcelletransplantasjon
Hvis en voksen får tilbakefall av akutt leukemi, er intensiv behandling med cellegift etterfulgt av stamcelletransplantasjon vanligvis den eneste behandling som kan føre til full helbredelse. Behandlingen er svært belastende på den syke, og kan derfor kun gjennomføres på relativt sett yngre pasienter uten andre sykdommer som belaster immunapparatet. Dette krever en individull vurdering og planlegging. I tilfeller der dødsrisiko ved transplantasjon vurderes å være for høy, er det i stedet aktuelt å gi nye cellegiftkurer i lavere doser. Dette kan ikke helbrede tilstanden, men det kan føre til betydelig forlengelse av overlevelsen uten å gå for mye på bekostning av livskvalitet.
Prognose
Prognosen er god ved ALL hos barn hvor nærmere ni av ti opplever varig helbredelse. Hos voksne har også prognosen blitt bedret de senere årene. I perioden 2012 til 2016 var fem-års overlevelse hos voksne med ALL mellom 40 til 66 prosent. Uten behandling er dødeligheten 100 prosent. Tall fra Barnekreftregisteret viste for perioden 2006 til 2015 at fem-års overlevelse for barn under 15 år var rundt 88 prosent for akutt lymfatisk leukemi og rundt 70 prosent for akutt myelogen leukemi. Dette er tall som samsvarer med internasjonale data.
Sykdommen er alvorlig, og behandlingen er tøff og krevende. I tillegg til de fysiske belastningene, er det mange som får psykiske reaksjoner med depresjoner og sorg, og noen får angstproblemer.
En spesiell komplikasjon er det som kalles fatigue. Dette er en unormalt sterk følelse av slitenhet og redusert utholdenhet som ikke bedres etter søvn eller hvile. Dette er belastende, og for mange kanskje den tyngste plagen etter at cellegiftkurene er tilbakelagt. Fatigue er generelt en hyppig følgetilstand hos personer som har blitt behandlet med stråling eller cellegift. Det finnes ingen rask og effektiv kur for dette. Men både erfaring og forskning tyder på at forsiktig, individuelt tilpasset trening er det som fungerer best. Mange blir kvitt plagene, etter kortere eller lengre tid.
Dette dokumentet er basert på det profesjonelle dokumentet Akutt lymfoblastisk leukemi . Referanselisten for dette dokumentet vises nedenfor
- Helsedirektoratet. Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av maligne blodsykdommer. IS-2746. Oslo, sept. 2018. www.helsedirektoratet.no
- Cortelazzo S, Ponzoni M, Ferreri AJM, Hoelzer D. Lymphoblastic lymphoma. Crit Rev Oncol Hematol 2011; 79: 330-43. PMID: 21273093 PubMed
- Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127: 2391-405. pmid:27069254 PubMed
- Danckert B, Ferlay J, Engholm G et al. NORDCAN: Cancer Incidence, Mortality, Prevalence and Survival in the Nordic Countries, Version 8.2 (26.03.2019). Hentet 30.04.19 www.ancr.nu
- Kreftregisteret. Cancer in Norway 2018. Oslo: Kreftregisteret, 2019. www.kreftregisteret.no
- Kolmannskog S, Flægstad T, Helgestad J, Hellebostad M, Zeller B, Glomstein A. Akutt lymfatisk leukemi hos barn i Norge 1992-2000. Tidsskr Nor Lægeforen 2007; 127: 1493-5. PMID: 17551551 PubMed
- Pui CH, Robison LL, Look AT.. Acute lymphoblastic leukaemia. Lancet 2008; 371: 1030-43. pmid:18358930 PubMed
- Freedman AS, Aster JC. Clinical manifestations, pathologic features, and diagnosis of precursor B cell acute lymphoblastic leukemia/lymphoma. UpToDate. Oct. 2016. www.uptodate.com
- Pui C-H, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med 2006; 354: 166-78. PMID: 16407512 PubMed
- Maury S, Chevret 1, Thomas X et al. Rituximab in B-Lineage Adult Acute Lymphoblastic Leukemia. N Engl J Med 2016; 375: 1144-53. pmid: 27626518 PubMed
- Fløisand Y1, Brinch L, Dybedal I et al. Allogen stamcelletransplantasjon hos voksne med akutt lymfoblastisk leukemi. Tidsskr Nor Laegeforen 2008; 128: 2563-6. pmid:19023351 PubMed
- Curran E, Stock W. How I treat acute lymphoblastic leukemia in older adolescents and young adults. Blood 2015;125: 3702-3710 Blood
- Bassan R, Hoelzer D. Modern therapy of acute lymphoblastic leukemia. J Clin Oncol 2011; 29: 532-43. PMID: 21220592 PubMed
- Rowe JM. Prognostic factors in adult acute lymphoblastic leukaemia. Br J Haematol 2010;150(4):389-405. PMID: 20573154 PubMed
- Marks DI. Treating the "older" adult with acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program 2010;American Society of Hematology. Education Program. 2010:13-20. PMID: 21239765 PubMed
- Ram R, Gafter-Gvili A, Vidal L, et al. Management of adult patients with acute lymphoblastic leukemia in first complete remission: Systematic review and meta-analysis. Cancer 2010; 116: 3447-57. PMID: 20564092 PubMed
- Lee HJ, Thompson JE, Wang ES, Wetzler M. Philadelphia chromosome-positive acute lymphoblastic leukemia. Cancer 2011;117(8):1583-94. PMID: 21472706 PubMed
- Goldstone AH, Rowe JM. Transplantation in adult ALL. Hematology Am Soc Hematol Educ Program 2009;593-601. PMID: 20008244 PubMed
- Jabbour E, O'Brien S, Ravandi F, et al. Monoclonal antibodies in acute lymphoblastic leukemia. Blood. 2015 ;125:4010-6. PMID: 25999456 PubMed
- Kantarjian HM, DeAngelo DJ, Stelljes M et al. Inotuzumab Ozogamicin versus Standard Therapy for Acute Lymphoblastic Leukemia. N Engl J Med 2016; 375: 740-53. pmid:27292104 PubMed
- Maude SL, Laetsch TW, Buechner J et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med 2018; 378: 439-48. pmid:29385370 PubMed
- Helsedirektoratet. Seneffekter etter kreftbehandling. Faglige råd. Oslo: Helsedirektoratet; 2017. IS-2551 oslo-universitetssykehus.no
- Tangen JM, Fløisand Y, Haukås E, Næss IA, Skjelbakken T, Stapnes C, et al. Overlevelse hos voksne med akutt lymfoblastisk leukemi. Tidsskr Nor Lægeforen 2010; 130: 1710-3. DOI: 10.4045/tidsskr.09.1293 DOI
- Tjønnfjord GE, Gedde-Dahl T, Heldal D, Brinch L. Treatment outcome in adults with acute lymphoblastic leukemia: 50% long-term disease-free survival. Leukemia 2007; 21: 2203-4. PMID: 17525727 PubMed
- Hijiya N, Hudson MM, Lensing S, et al. Cumulative incidence of secondary neoplasms as a first event after childhood acute lymphoblastic leukemia. JAMA 2007; 297: 1207-15. PMID: 17374815 PubMed
- Pui C-H, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med 2004; 350: 1535-48. PMID: 15071128 PubMed
- Martell MP, Atenafu EG, Minden MD et al. Treatment of elderly patients with acute lymphoblastic leukaemia using a paediatric-based protocol. Br J Haematol 2013; 163: 458-64. pmid:24033272 PubMed